在细胞治疗产品的生产与制备过程中,维持绝对的无菌环境是保障产品安全性的生命线。然而,复杂的培养基成分和漫长的生产流程,使得细胞产品极易遭受细菌、真菌、支原体等微生物的污染。这些污染源会严重威胁细胞产品的质量、安全性与有效性,因此,对活菌污染进行严格的质量控制(质控)至关重要。
核酸是微生物的特异性遗传物质信号源,微生物检测一个重要的途径就是对其核酸进行检测,这种检测方法相比较传统培养法更方便快捷且更灵敏。所有基于 PCR 或测序的微生物污染检测,其准确性与灵敏度都高度依赖于一个前提:从复杂样本中成功提取出高质量的微生物核酸。可以说,核酸提取是微生物活菌污染质控的 “第一道门槛”。
当前细胞治疗产品的核酸提取面临多重挑战:样本类型复杂多样、细胞浓度波动范围大、部分样本可能含有酶抑制剂,且行业对检测通量、灵敏度、成本的需求各不相同。目前核酸提取的方法包括柱提法、磁珠法和热裂解法。其中,柱提法相对更为传统,其优点是提取的核酸质量较高,效果稳定,但操作时间长,步骤繁琐,且需要搭配高速离心机使用,难以实现通量提取,难以匹配高效率高通量的产业化质控需求。磁珠法与高效热裂解法是当前适配细胞治疗活菌质控场景的主流优选方案,二者各有侧重,可满足不同场景的检测需求。
01 核酸提取的核心原则
活菌检测的核酸提取需精准匹配 “仅捕获活菌特异性信号” 的核心需求,无论采用何种方法,成功的核酸提取都需严格遵循五大核心原则,这直接决定了后续活菌检测的成败:
保证完整性:维持核酸分子的一级结构完整,获得足够长度的核酸片段,同时全程避免核酸降解(活菌特异性核酸易受酶解影响)。
确保高纯度:去除蛋白质、多糖、多酚、有机溶剂、金属离子及宿主细胞杂质,防止干扰后续反应。
避免抑制物:确保提取的核酸中不含对后续酶反应(如逆转录、PCR)有抑制作用的物质,同时彻底消除核酸酶污染,避免目标核酸降解。
防止污染:杜绝外源核酸污染及样本间的交叉污染,避免假阳性结果,保障活菌检测的特异性。
适配活菌检测:提取流程需针对性保留活菌特有的核酸信号,排除死菌残留干扰,确保提取产物能精准反映样本中活菌实际污染状况。
只有满足以上原则,提取出纯度高、无抑制物、结构完整的核酸,活菌检测结果才能真实反映污染状况,为细胞产品的安全放行保驾护航。
02 核心技术解析:磁珠法vs高效热裂解法
磁珠法提取
一、核心原理
以表面修饰功能基团(如硅羧基)的核壳型磁性微球为载体,通过调节溶液环境实现核酸的特异性吸附与可逆解吸附。在高盐、促沉淀试剂(如 PEG)作用下,核酸分子构象改变并暴露负电基团,借助离子桥与磁珠表面基团结合;利用外部磁场快速分离结合核酸的磁珠,经洗涤去除杂质后,切换至低盐、水性洗脱环境,解除核酸与磁珠的结合作用,使核酸溶解于洗脱液中,最终完成纯化。
二、操作流程
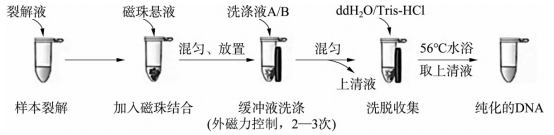
样本裂解:向细胞 / 组织样本中加入裂解液,充分反应以破坏细胞膜,释放核酸及杂质。
磁珠结合:加入表面修饰硅羧基的核壳型磁珠与 NaCl、PEG 试剂,混匀后核酸通过离子桥与磁珠特异性结合。
磁吸除杂:将反应管置于磁场中,磁珠(结合核酸)被吸附固定,倾倒或抽吸去除含杂质的废液。
洗涤纯化:移除磁场,加入洗涤液重悬磁珠,再次磁吸弃液,重复2-3 次以彻底洗净残留杂质。
核酸洗脱:加入洗脱液,混匀后静置片刻,解除核酸与磁珠的结合;最后磁吸分离磁珠,收集上清液即得纯化核酸。
三、性能特点
提取纯度高:磁珠与核酸特异性结合,可高效去除蛋白、多糖、抑制剂及核酸酶等杂质,满足 PCR、测序等下游实验对核酸质量的严苛要求。
样本兼容性广:适配 10³-10⁷个不同浓度的细胞样本,且对复杂样本基质耐受性强,能适配多种样本类型。
操作规范稳定:流程标准化,无需离心、过柱等复杂步骤,人为误差可控,重复性好,保障批量样本提取质量一致。
支持自动化:可搭配自动化设备使用,大幅缩短提取时间、提升检测通量,同时降低人力与时间成本。
高效热裂解法提取
一、核心原理
以传统热裂解 “90-100℃高温破坏细胞结构” 为基础,搭配专用优化裂解液,靶向破坏细菌、真菌、支原体的外壳,实现更彻底的细胞破碎,让核酸大片段充分释放;裂解液内置去抑制配方,减少蛋白、代谢产物等杂质残留,同时消除对下游 PCR 的抑制作用;经简单离心去除细胞碎片,无需额外纯化,直接获得可用于下游实验的核酸样本。
二、操作流程
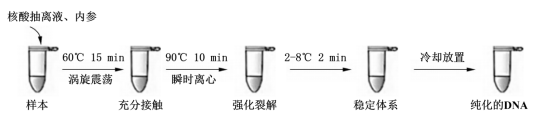
样本清洗与富集:向离心管中加入 1mL 高压无菌纯化水,涡旋振荡 1 分钟后,以 15000g 离心 10 分钟;弃去上清液,操作时避免刮蹭管底沉淀。
裂解液与内参添加:向离心管中加入 30μL 核酸提取液 1、2μL 核酸提取液 2,再按需求加入内参质控品,涡旋振荡 1 分钟充分混匀。
梯度加热裂解:短暂离心使管壁液体汇集至管底,将离心管置于 60℃水浴 / 金属浴中加热 15 分钟;加热结束后迅速升温至 90℃(尽快完成升温)。取出离心管,涡旋振荡 10 秒,短暂离心后置于 90℃水浴 / 金属浴中加热 10 分钟(若温度未达 90℃,可先室温放置)。
产物收集与保存:取出离心管,短暂离心使液体汇集至管底,得到的核酸溶液于 2~8℃放置 2 分钟冷却。
三、性能特点
高效热裂解法兼具 “快速、稳定、高敏、低成本” 的核心优势:
操作极简高效:保留传统热裂解的低门槛,仅需加热装置(水浴 / 金属浴)+ 专用裂解液,单样本提取时间仅 40 分钟,新手可快速上手;
裂解彻底,得率更高:针对细菌、真菌、支原体等多种微生物实现深度破壁,核酸释放更充分,有效得率优于传统热裂解;
无下游抑制风险:裂解液经优化设计,提取的核酸可直接用于 PCR、qPCR等实验,解决了传统热裂解 “粗提物干扰检测” 的痛点;
成本可控:无需柱材、磁珠等昂贵耗材,专用裂解液成本低于传统纯化试剂盒,尤其适合大规模样本处理场景;
污染风险低:操作步骤精简,避免繁琐流程中可能引入的外源污染,减少样本检测假阳性的概率;
灵敏度突出:对低浓度样本的捕获能力强,尤其适配监管趋严下的高灵敏度检测需求。
03 友康生物的技术选择与创新突破
基于对行业需求的深入理解,我们发现细胞治疗质控正面临三重挑战:从研发走向产业化,要求检测通量实现从 “样本级” 到 “产线级” 的跨越;监管趋严推动检测灵敏度要求不断提升;同时企业还需平衡质量控制与运营成本。这些洞察直接指引了我们的技术布局:针对高纯度、高完整性核酸提取需求开发磁珠法方案,为快速筛查、高灵敏度检测优化热裂解法路线,形成优势互补的双轨战略,全方位满足不同场景的检测需求。

| 产品名称 | 产品货号 | 产品规格 |
| 细菌、真菌、支原体专用核酸提取试剂盒(磁珠法) | MK0103-50 | 50T/盒 |
| 细菌、真菌、支原体专用核酸快速提取试剂盒 | MK0104-50 | 50T/盒 |
| 核酸提取试剂扩展包 | MK0105-50 | 50T/盒 |
一、产品优势
适配性广:提取到的核酸可搭配本公司细菌、真菌、支原体三类检测试剂盒,一次提取满足多类微生物检测需求;
活菌精准检测:基础包适配常规样本,扩展包可去除非活菌核酸污染,确保检测结果仅针对活菌;
样本兼容性强:能高效处理菌体稀释液、细胞培养混合液等多种样本,适配 MSC、NK、HEK293 等细胞培养物;
检测性能优异:核酸得率高,搭配 qPCR 检测试剂盒可实现高灵敏度、高特异性检测;高效热裂解法试剂盒无需昂贵耗材与设备,灵敏度优于传统磁珠法。
二、实测数据验证:产品性能优势凸显
综合细胞制剂(NK 细胞、MSC、HEK293 细胞)与对应无血清培养基两类样本,针对细菌、真菌、支原体三种检测对象及全浓度梯度(1、10、100 CFU/mL)的检测数据显示,高效热裂解法具备显著性能优势。
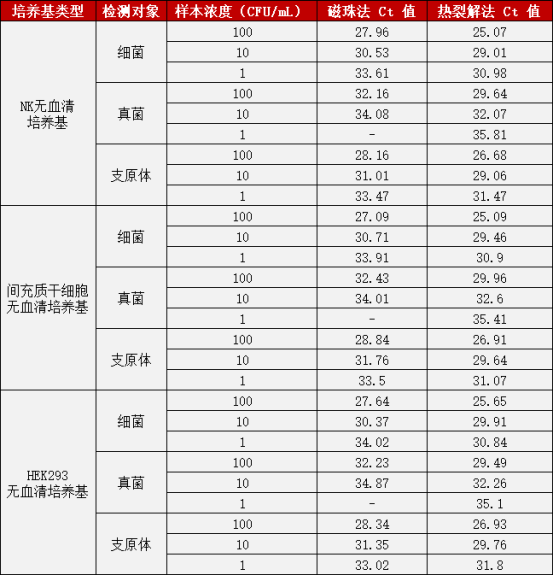
验证一:培养基样本提取后检测细菌、真菌、支原体
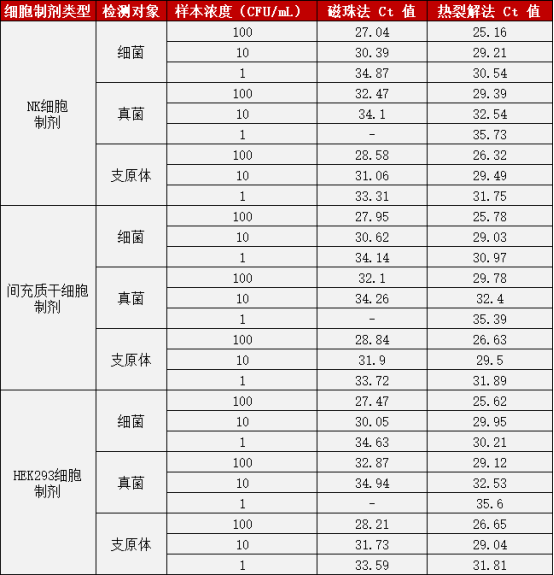
验证二:细胞制剂样本提取后检测细菌、真菌、支原体
注:Ct 值越低,代表核酸提取效率越高,检测灵敏度越强;“-” 表示未稳定检出。
从数据可以清晰看出:在低浓度(1 CFU/mL)真菌样本检测中,可对所有细胞制剂及培养基样本实现稳定检出,Ct 值处于合理区间;在细菌、支原体的全浓度梯度检测中,Ct 值表现更优,体现出更强的核酸提取效率与模板富集能力;此外,该方法在细胞制剂与培养基两大应用场景中无检测盲区,结果稳定性与一致性突出,能够充分满足生物制药领域细胞培养相关的微生物质控检测需求。
结语
核酸提取是细胞产品微生物质控的基础,选择合适的提取方法是保障检测准确性、高效性的关键。磁珠法与高效热裂解法各有侧重,需结合检测场景、样本类型、通量需求及成本预算综合考量。友康生物通过双轨战略布局与产品创新,为不同需求场景提供针对性解决方案,助力细胞治疗产品质控更精准、更高效、更便捷。

 友康生物
友康生物 2025-12-30
2025-12-30 行业热点
行业热点



